Исследование функциональной активности биомолекул
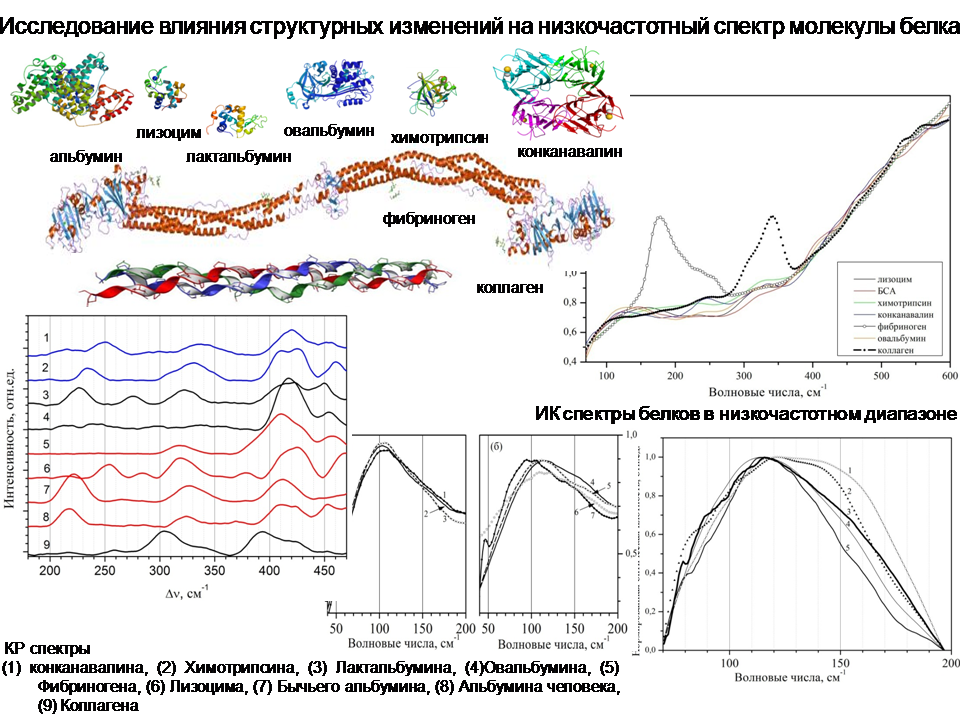
Одним из направлений работы лаборатории является исследование структуры молекул белков методами оптической спектроскопии.
Спектроскопия биологических объектов - интересное и развивающееся направление прикладной физики. Стремление к улучшению уровня жизни, к познанию различных биологических процессов и желание управлять ими приводят к необходимости расширять существующие методы получения информации об объекте, его составе, структуре и функциях.
Применение
методов оптической спектроскопии в изучении биологических объектов является
одним из наиболее распространенных и эффективных способов получения информации
о составе, строении веществ на различных структурных уровнях, а также об
изменениях, происходящих с исследуемым объектом при изменении условий
окружающей среды. 
Они принимают участие во всех процессах жизнедеятельности - катализируют важнейшие реакции в клетках, являются регуляторами генетических фунций нуклеиновых кислот, участвуют в процессах запасания, передачи, трансформации сигналов в живых организмах. Белковые молекулы и их свойства играют важную роль и в современных биотехнологиях.
На основании результатов большого количества исследований белковых молекул и их функционирования была сформулирована и предложена концепция «белок-машина» [1,2,3]. Основана эта теория на взаимосвязи функциональных свойств белка и структуры его молекулы. Авторами концепции было предложено рассматривать молекулу белка как «машину» (механическую конструкцию), состоящую из отдельных частей, обладающих разной подвижностью и упругостью. Функционирование такой машины идет по заранее определенному, запрограммированному плану, связанному с движением крупных элементов конструкции (доменов структуры молекулы) друг относительно друга. Такими доменами могут являться элементы вторичной структуры белка (α-спиральные, β-структурные элементы), а также и более крупные фрагменты третичной и четвертичной структуры белков.
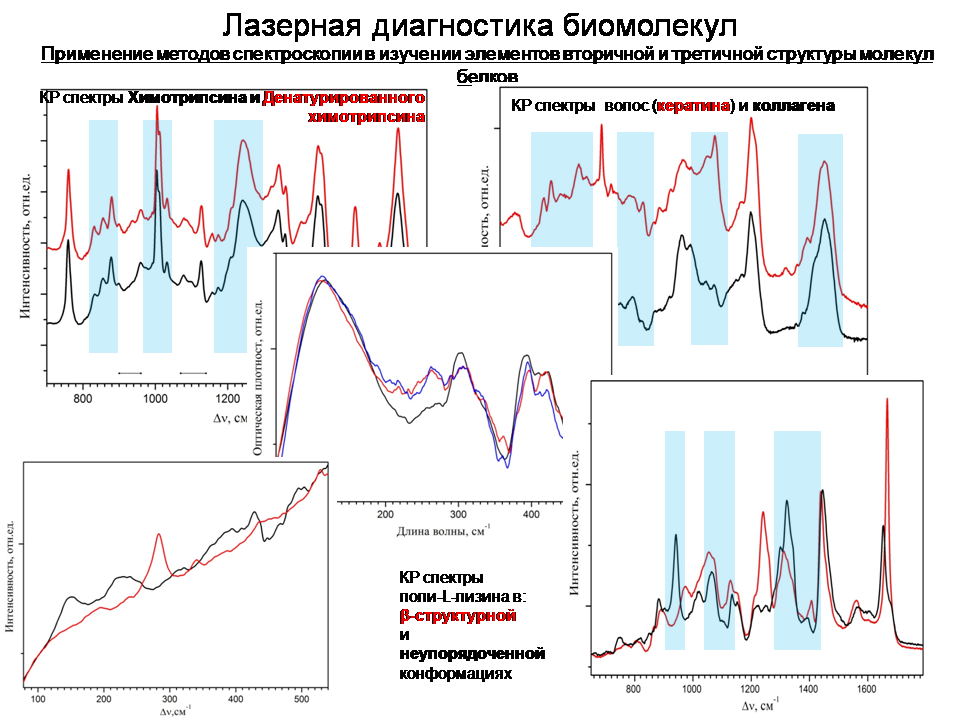
Одними из наиболее успешных и информативных инструментов исследования структуры биологических объектов являются методы лазерной КР и ИК-Фурье спектроскопии. Огромное количество работ посвящено изучению колебательного спектра молекул белков этими методами. Была наработана обширная база данных, позволяющая по наличию тех или иных линий в спектрах образцов идентифицировать объект, сделать вывод о его структуре и о различных процессах, происходящих с ним при изменении стандартных условий окружающей среды. Проведенные исследования позволили соотнести линии спектра белка элементам их структуры [4,5,6,7]. Как известно, белки являются полипептидами, колебательный спектр которых, в основном, состоит из нормальных мод колебаний полипептидной цепи. Это девять характеристических линий колебательного спектра белка: амид A, B, I, II, …, VII. [8,9,10,11], чувствительных к изменениям в конформации белковой молекулы. Успехи исследований в этом направлении позволяют сегодня получать достоверную количественную информацию о процентном содержании элементов вторичной структуры в молекуле белка по результатам анализа формы и интенсивности этих линий. Помимо нормальных мод колебаний пептидной связи, в колебательном спектре белков проявляются также и другие характеристические линии. Например, линии колебаний функциональных групп и одиночных аминокислот, входящих в состав белка. В основном они проявляются в так называемом диапазоне «отпечатков пальцев» (500-1700 см-1). Как известно, методы ИК и КР спектроскопии являются взаимодополняющими, то есть линии, которые наблюдаются в ИК спектрах белков, могут не проявляться в спектрах комбинационного рассеяния, и наоборот. Поэтому совместное применение этих методов расширяет получаемую информацию. Так, в КР спектрах белков в диапазоне «отпечатков пальцев» расположены некоторые известные конформационно-чувствительные линии спектра, например, линии дисульфидных мостиков (500-550 см-1). Они служат для поддержания третичной и четвертичной структуры молекулы белка. Разрыв дисульфидных связей может привести к разворачиванию молекулы и, следовательно, к потере/изменению функциональных свойств белка. Тирозиновый дублет (830-850 см-1) также проявляется в КР спектре белков в диапазоне «отпечатков пальцев». Отношение интенсивностей линий дублета характеризует количество спрятанных и открытых тирозиновых групп. Линии ароматических аминокислот триптофана и фенилаланина проявляются в выделенном диапазоне и позволяют делать выводы о строении молекул. Исследованию этих линий посвящено множество работ, например, работы [12,13,14]. Отметим, что получаемые результаты хорошо согласуются с данными рентгеноструктурного анализа.

Таким образом, современные данные позволяют исследовать первичную и вторичную структуру молекул белков, однако информация о наличии линий колебательных спектров, соответствующих их третичной или четвертичной структуре, практически отсутствует. Тем не менее, особенности этих высших уровней организации структуры молекулы также определяют появление конкретных биологических свойств белков. Для понимания работы молекулы белка необходимо иметь возможность определять изменения во всех ступенях иерархической цепочки структуры молекулы.
Прогресс в экспериментальной технике привел к повышению эффективности спектроскопических исследований в низкочастотном (терагерцовом) диапазоне (40-500 см-1, 1-15 ТГц) и возможностям его применения к изучению биологических структур. Несмотря на то, что в данный момент этот спектральный диапазон не так хорошо изучен, как диапазон «отпечатков пальцев», в литературе можно найти некоторую информацию о соответствии линий низкочастотного спектра каким-то определенным структурным элементам или функциональным группам [15,16,17,18,19]. И все же эти приписки не являются однозначными и четкими. Необходимо развивать это перспективное направление, расширять существующие базы данных. Тем более теоретические оценки и результаты расчетов при помощи методов молекулярной динамики показывают, что колебания крупных фрагментов молекул белков могут проявляться в этом низкочастотном интервале. Можно ожидать, что спектральные изменения, наблюдаемые в низкочастотном диапазоне спектра, и их анализ также позволят характеризовать третичную и четвертичную структуру белковых молекул.
2. Chernavsky, D.S., Chernavskaya, N.M. Protein-machine. Biological macromolecular constructions. Moscow: Moscow Univer. 1999 (in Russian), p.248.
3. Khurgin, Yu.I., Chernavsky, D.S., Shnol, S.E. Molecular biology (Moscow), 1967; Volume 1, pp. 419-426.
4. Kong, J., Yu, S. Fourier Transform Infrared Spectroscopic Analysis of Protein Secondary Structures. Acta Biochimica et Biophysica Sinica 2007, 39(8), pp. 549–559.
5. Celej, M.S., D'Andrea, M.G., Campana, P.T., Fidelio, G.D., Bianconi, M.L. Superactivity and conformational changes on α-chymotrypsin upon interfacial binding to cationic micelles. Biochem. J. 2004, 378(3), pp.1059–1066.
6. Dong, A, Prestrelski, S.J., Allison, S.D., Carpenter, J.F. Infrared Spectroscopic studies of lyophilization- and temperature-induced protein aggregation. Journal of Pharmaceutical sciences 1995, 84(4), pp. 415-424.
7. Maiti, N.C., Apetri, M.M., Zagorski, M.G., Carey, P.R., Anderson, V.E. Raman Spectroscopic Characterization of Secondary Structure in Natively Unfolded Proteins: r-Synuclein. J. am. chem. Soc. 2004, 126(8), pp. 2399-2408.
8. Byler, D.M., Susi, H. Examination of the secondary structure of proteins by deconvolved FTIR spectra. Biopolymers 1986, 25(3), pp. 469-487.
9. Susi, H. Infrared Spectroscopy – Conformation. Methods Enzymol. 1972, 26, pp. 445-472.
10. Miyazawa, T., Shimanouchi, T., Mizushima, S.I. Characteristic Infrared Bands of Monosubstituted Amides. J. Chem. Phys. 1956, 24, pp. 408-418.
11. Bandekar, J. Amide modes and protein conformation. Biochim Biophys Acta 1992, 1120(2), pp. 123−143.
12. Brandt, N.N., Chikishev, A.Y., Sotnikov A.I. et al. Ricin, ricin agglutinin, and the ricin binding subunit structural comparison by raman spectroscopy. Journal of Molecular Structure. 2005, 735, pp. 293–298.
13. Brandt, N.N., Sakodynskaya, I.K., Chikishev A.Y. A study of interaction between alpha-chymotrypsin and 18-crown-6 in organic solvents by raman spectroscopy. Russian Journal of Physical Chemistry A., 2001, 75 (6), pp. 928–932.
14. Brandt, N.N., Chikishev, A.Yu., Greve, J., et al. Cars and raman spectroscopy of function related conformational changes of chymotrypsin. Journal of Raman Spectroscopy, 2000, 31, pp. 731–737.
15. Balakhnina, I.A., Brandt, N.N., Chikishev, A.Yu., Mankova, A.A., Shpachenko, I.G. Low-frequency vibrational spectroscopy of proteins with different secondary structures. J. Biomed. Opt., 2017, 22 (9), c. 091509.
16. Mankova A.A., Brandt.N.N., Chikishev A.Yu. Raman and FTIR spectroscopy in the THz frequency range in the study of protein structure. Журнал прикладной спектроскопии, 2016, 83 (6-16), с. 714.
17. Stehle, C.U., Abuillan, W., Gompf, B., Dressel, M. Far-infrared spectroscopy on free-standing protein films under defined temperature and hydration control. J. Chem. Phys., 2012, 136 (7), c. 075102-1 - 075102-8.
18. Spiro, T.G., Gaber, B.P. Laser Raman scattering as a probe of protein structure. Ann. Rev. Biochem., 1977, 46, c. 553-572.
19. Нурхаметов, А.Х., Елякова, Е.Г., Ефремов, Е.С., Мирошников, А.И. Пространственная структура апамина в растворе. Анализ спектров лазерного комбинационного рассеяния. Биоорганическая химия, 1981, 7 (1), c. 16-24.